可视化完整活生物体内的生物分子和细胞过程是化学生物学的主要目标。然而,由于组织对光的散射,主要基于荧光发射的现有分子生物传感器在这种情况下具有有限的用途。相比之下,超声波可以轻松地以高时空分辨率对深部组织成像,但缺少将其对比度与特定生物分子(例如酶)的活性联系起来所需的生物传感器。
【科研摘要】
为了克服上述局限性,美国加州理工学院Mikhail G. Shapiro教授团队引入了第一个可遗传编码的声学生物传感器,即响应蛋白酶活性而在超声成像中“点亮”的分子。这些生物传感器基于一类独特的充气蛋白质纳米结构,称为气体囊泡(GVs),作者将其设计为响应三种不同蛋白酶的活性而产生非线性超声信号。证明了这些生物传感器能够在体外,改造的益生菌内部以及小鼠胃肠道体内成像。相关成果以题为“Acoustic biosensors for ultrasound imaging of enzyme activity”发表在7月《Nature Chemical Biology》杂志上。

【图文探讨】
假设可以设计出基于GV的生物传感器,这些传感器可以根据特定生物分子的活性动态改变其超声对比度。这种可能性源自最近的发现,即GV的声学特性可以在其组成蛋白的水平上得到修饰。特别是,位于GV表面(图1)并提供结构增强作用的支架蛋白气囊泡蛋白C(GvpC)可以在其氨基酸序列水平进行修饰,从而改变GV力学。

图1:烟草蚀刻病毒(TEV)内肽酶的声学生物传感器。
1.设计TEV内肽酶的声传感器
为了检测TEV的活性,作者设计了一个包含TEV识别基序ENLYFQ'G的GvpC变体(图1b),假设将GvpC切割成两个较小的片段会导致GV壳变硬,从而使其屈曲并产生增强的非线性超声对比度。确定了一种工程改造的GV变体,与活性TEV蛋白酶孵育后,其崩溃压力中点降低了约70 kPa(图 1c)。在GVSTEV上GvpC的TEV切割有望产生分子量分别约为9和14 kDa的N和C末端片段。确实,暴露于活性TEV后GVSTEV的凝胶电泳导致出现了两个裂解的GvpC片段,并且完整的GvpC谱带强度大大降低(图1d)。此外,通过浮力纯化GV从未结合片段的溶液中去除,导致N末端裂解片段的条带强度降低,表明其在裂解后部分解离(图1d)。与dTEV孵育后,未观察到GvpC带强度的显着变化。透射电子显微镜(TEM)图像显示两种条件下完整的GV具有相似的外观,这证实蛋白酶切割不会影响下面的GV壳的结构(图1e)。动态光散射(DLS)在与dTEV和活性TEV蛋白酶一起孵育后,工程GV的流体动力学直径没有显着差异,这证实了GV仍然分散在溶液中(图1f)。
通过超声对其进行了成像。公开GVSTEV样品对TEV蛋白酶产生了很强的非线性声响应,在施加的438 kPa声压下,最大对比度噪声比(CNR)增强了约7分贝(dB)(图1g)。在暴露于dTEV的对照中,观察到的非线性对比度明显较低,而正如预期的那样,两个样品均产生相似的线性散射。与GV壳的压力相关力学一致,GVSTEV的微分非线性声学响应在高于295kPa的压力下变得明显,并一直保持增加到556 kPa,这时GV开始坍塌(图1h)
2. 设计钙蛋白酶的声学传感器
在使用模型TEV蛋白酶验证了基本声学生物传感器设计后,作者检查了其对其他内肽酶的通用性。通过将源自α-血影蛋白的识别序列QQEVY’GMMPRD33插入到Ana GvpC中,作者设计了μ-钙蛋白酶的声学生物传感器(图2a)。在有或没有钙蛋白酶和Ca2+的缓冲液中进行的加压吸收光谱使能够确定钙蛋白酶的GV传感器(GVScalp),显示在存在酶及其离子活化剂的情况下静水压塌压力降低了约50 kPa(图2b)。
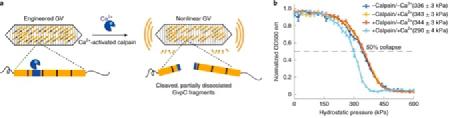
图2:钙激活钙蛋白酶蛋白酶的声学生物传感器。
3. 建立蛋白酶ClpXP的声音传感器
除了内肽酶,参与细胞蛋白质信号传导和体内平衡的另一类重要酶是过程性蛋白酶,其从其末端开始展开并降解完整的蛋白质。为了确定是否可以针对此类酶开发基于GV的生物传感器,作者选择了ClpXP,这是一种来自大肠杆菌的过程性蛋白水解复合物,包含解折叠酶ClpX和肽酶ClpP。ClpX识别并展开包含称为degrons的特定末端肽序列的蛋白质底物。然后将未折叠的蛋白质送入ClpP,后者将它们降解为小肽片段。假设在GvpC的C末端添加一个degron将使ClpXP识别并降解该蛋白,同时保留完整的基础GvpA外壳,从而使GV具有更大的机械柔韧性和非线性超声对比(图3a)。
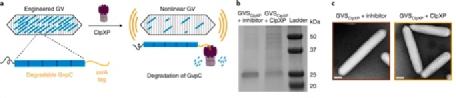
图3:ClpXP蛋白酶的声学生物传感器。
4. 构建细胞内声学传感器基因
在演示了声学生物传感器的体外性能后,作者努力证明它们可以对活细胞内部的酶活性作出反应。作为细胞宿主,选择了大肠杆菌Nissle 1917菌株。该大肠杆菌的益生菌菌株可以在哺乳动物胃肠道中定殖,被广泛用作微生物治疗剂开发的基础,使其成为细胞内生物传感器的重要平台。为了开发针对ClpXP(ASGClpXP)的细胞内声学传感器基因(ASG),作者将ARG基因簇(ARGWT)中的WT gvpC与可降解GVSClpXP的修饰gvpC进行了交换(图4a)。
接下来,为了检查ASGClpXP以动态方式响应细胞内酶活性的能力,作者通过基因组敲除编码ClpX和ClpP的基因,生成了一个Nissle细胞(ΔclpXP),并创建了包含这两个质粒的质粒基因(图4a)。这能够从外部控制ClpXP酶的活性。ΔclpXP Nissle细胞与可诱导的clpX-clpP(clpXP)质粒和ASGClpXP共转化。用L-arabinose诱导后,这些细胞中ClpXP的产生导致静水压塌点中点降低约160 kPa(图4b)。在超声成像下,与未诱导该蛋白酶的细胞相比,具有诱导的ClpXP活性的细胞显示出明显更强的非线性对比度(+6.7 dB)(图4c),同时显示出类似的B型信号。在高于950 kPa的声压下,可以检测到非线性信号增强(图4d)。这些实验证明了ASGClpXP能够充当细胞内声学传感器来监测可变酶活性的能力。
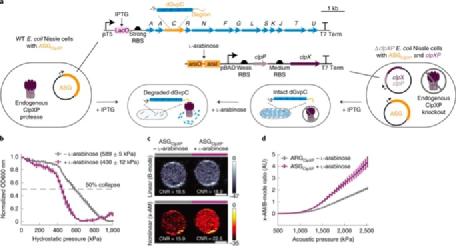
图4:监测工程细胞中的细胞内蛋白酶活性和电路驱动的基因表达。
5. 体内细胞内ClpXP活性超声成像
在建立体外声学生物传感器工程的基本原理并证明其在活细胞中的性能后,作者评估了传感器构建体在体内生物学相关解剖位置内产生超声对比的能力。由于胃肠道在动物体内的位置相对较深,并且在临床诊断和胃肠道病理动物模型中使用超声,并采取了适当的措施以最大程度地减少气泡和固体物质的潜在干扰,因此胃肠道也是超声成像的极佳目标。
为了证明声学生物传感器在小鼠胃肠道的体内环境中产生非线性超声对比的能力,首先将表达ASGClpXP和ARGWT的WT Nissle细胞共注射到小鼠结肠中。沿管腔壁的细胞群,另一个位于管腔中心。将细胞通过直肠注射的琼脂糖水凝胶引入结肠,以实现精确定位和控制组成。使用非线性超声成像,可以清楚地将蛋白酶敏感ASG产生的独特对比度可视化为衬在结肠周围的明亮对比环(图5a)。使用来自换能器的高压脉冲,在GV声塌陷之前和之后采集的超声图像进行比较,确认非线性对比度的亮环是来自表达ASGClpXP的细胞(图5a)。在九只小鼠的独立实验中,该结果是一致的(图5b)。
为了证明酶活性的体内成像,作者将表达ASGClpXP的ΔclpXP Nissle细胞引入小鼠结肠中,无论是否转录激活细胞内ClpXP(示意图均显示在图6中)。如前所述,细胞被包含在琼脂糖水凝胶中。与不表达ClpXP的细胞相比,诱导表达该酶的细胞显示出增强的非线性对比(图5c)。声塌陷证实了声生物传感器是非线性信号的主要来源(图5c)。该性能在七只小鼠和细胞的两个空间排列中是一致的(图5d)。这些结果证明了声学生物传感器在体内成像的背景下可视化酶活性的能力。

图5:在小鼠胃肠道中表达ASG的细菌的超声成像。
【陈述总结】
该结果建立了用超声成像无创地观察蛋白酶活性的范例。该研究有助于未来的大量研究,以将声蛋白酶传感器的应用范围扩展到本研究所示的概念验证演示之外。而在大肠杆菌中的实验并且在小鼠胃肠道内建立了这种生物传感器在相关生物学环境中产生超声对比的关键能力,其他以应用程序为中心的优化将使这些构建物能够用于解决基础生物学和合成生物学中的特定问题。同时,存在很大的空间用于进一步优化和推广声学生物传感器的设计。